doi: 10.56294/mw2024.576
ORIGINAL
Genetic variability of human papillomavirus genotypes 16 and 18 and its association with cervical cancer
Variabilidad genética del virus del papiloma humano genotipos 16 y 18 y su asociación con el cáncer cervical
Rosa M. Macías1
![]() *,
Nayeli Y. Tejena1
*,
Nayeli Y. Tejena1 ![]() * , Eugenio R. Borroto1
* , Eugenio R. Borroto1
![]() *
*
1Universidad San Gregorio de Portoviejo, Carrera de Medicina. Manabí, Ecuador.
Citar como: Macías RM, Tejena NY, Borroto ER. Genetic variability of human papillomavirus genotypes 16 and 18 and its association with cervical cancer. Seminars in Medical Writing and Education. 2024; 3:.576. https://doi.org/10.56294/mw2024.576
Enviado: 06-12-2023 Revisado: 14-02-2024 Aceptado: 11-05-2024 Publicado: 12-05-2024
Editor: PhD.
Prof. Estela Morales Peralta ![]()
Autor para la correspondencia: Rosa M. Macías *
ABSTRACT
This study explores the relationship between the genetic variability of Human Papillomavirus (HPV) types 16 and 18 and their impact on the aggressiveness of cervical cancer. These genotypes account for 73 % of global cases, and their integration into the host genome leads to the overexpression of viral proteins E6 and E7, which interfere with the tumor suppressors p53 and Rb, promoting oncogenesis. The objective of this research was to analyze through various studies the relationship between specific genetic variants of HPV-16 and HPV-18 and the increased aggressiveness of cervical cancer. A systematic review of articles published between 2000 and 2023 was conducted, selecting 30 relevant studies. The findings suggest that variability in the E6, E7 genes, and the long control region (LCR) directly impacts oncogenesis by altering viral transcription and immune response, increasing cancer risk. These variations can serve as biomarkers for diagnosis and prognosis.
Keywords: Human Papillomavirus; Cervical Cancer; Oncogenic Aggressiveness; Genetic Variability; HPV16; HPV18.
RESUMEN
Este estudio explora la relación entre la variabilidad genética de los tipos 16 y 18 del Virus del Papiloma Humano (VPH) y su impacto en la agresividad del cáncer cervicouterino. Estos genotipos representan el 73 % de los casos globales y su integración en el genoma del huésped lleva a la sobreexpresión de las proteínas virales E6 y E7, las cuales interfieren con los supresores de tumores p53 y Rb, promoviendo la oncogénesis. El objetivo de esta investigación consiste en analizar mediante diversos estudios la relación existente entre las variantes genéticas específicas de VPH-16 y VPH-18 con una mayor agresividad del cáncer cervicouterino. Se realizó una revisión sistemática de artículos publicados entre 2000 y 2023, seleccionando 30 estudios relevantes. Los hallazgos sugieren que la variabilidad en los genes E6, E7 y la región de control largo (LCR) impacta directamente en la oncogénesis, alterando la transcripción viral y la respuesta inmunitaria, incrementando el riesgo de cáncer. Estas variaciones pueden servir como biomarcadores para diagnóstico y pronóstico.
Palabras clave: Virus Del Papiloma Humano; Cáncer Cervicouterino; Agresividad Oncogénica; Variabilidad Genética; VPH16; VPH18.
INTRODUCCIÓN
El cáncer cervical es la cuarta causa de muerte de mujeres del mundo, siendo el virus del papiloma humano (VPH) el agente etiológico principal (Collazo et al, 2019), el cual es un virus de ADN circular de doble cadena con un tamaño de genoma de aproximadamente 8000 pares de bases que codifica varias proteínas tempranas (E1, E2, E5, E6 y E7) y tardías (L1, L2 y E4) (Shen, 2013). Entre los más de 200 genotipos identificados, los tipos 16 y 18 del VPH son los principales agentes etiológicos del cáncer cervical, responsables de aproximadamente el 73 % de los casos a nivel mundial (Frati, 2011). Este virus de alto riesgo se integra en el genoma del huésped, un proceso que afecta diversas vías celulares y promueve la oncogénesis, especialmente a través de la interrupción del gen E2 y la sobreexpresión de las oncoproteínas E6 y E7 (Mandal, 2013).
La proteína E2 del VPH16 regula el ciclo de vida viral, incluyendo la transcripción, replicación y segregación del genoma viral. Cuando el VPH se integra en el genoma del huésped, se interrumpe la represión mediada por E2, lo que resulta en la sobreexpresión de E6 y E7, proteínas que desregulan la maquinaria celular, facilitando la transformación de las células infectadas (Ramírez, 2020). La interacción de E2 con la proteína supresora de tumores p53 influye en la estabilidad y función de p53, una proteína clave en la respuesta celular al estrés y la reparación del ADN, destacando la complejidad del papel de E2 en la oncogénesis inducida por VPH (Ramírez, 2020).
Las oncoproteínas E6 y E7 del VPH16 y VPH18 son factores críticos en la cascada de eventos que llevan al desarrollo del cáncer cervical. E6 se asocia con la degradación de p53, mientras que E7 se une a proteínas reguladoras del ciclo celular como el retinoblastoma (Rb), lo que desregula el ciclo celular y favorece la proliferación celular (Lechner, 1992; Estevao, 2019). Este desequilibrio en la expresión de E6, E7 y E5 es potenciado por los mecanismos de integración e hipermetilación del genoma viral, contribuyendo al proceso oncogénico (Estevao, 2019). La proteína L1 ha sido un componente clave en las vacunas profilácticas, debido a su capacidad para inducir anticuerpos neutralizantes (Frati, 2011). Variaciones en genes como E6 y la región de control largo (LCR) podrían alterar el potencial oncogénico del VPH16, lo que hace necesario un enfoque personalizado en la prevención y tratamiento del cáncer cervical (Yue et al, 2013).
La variabilidad genética de los tipos 16 y 18 del VPH representa un desafío en la lucha contra el cáncer cervical. Entender cómo estas variantes influyen en la oncogénesis es crucial para ajustar las estrategias de prevención y tratamiento, permitiendo mejorar las vacunas existentes y desarrollar herramientas de diagnóstico más precisas. De esta manera, se fortalecen los esfuerzos para reducir la incidencia del cáncer cervical. Por lo tanto, el objetivo de esta investigación consiste en analizar mediante diversos estudios la relación existente entre las variantes genéticas específicas de VPH-16 y VPH-18 con una mayor agresividad del cáncer cervicouterino.
MÉtodo
Este estudio se basa en un enfoque cualitativo y documental, mediante una revisión sistemática de la literatura científica sobre la variabilidad genética del Virus del Papiloma Humano (VPH) y su relación con el cáncer cervical en mujeres. Se empleó un diseño analítico que integra diferentes tipos de estudios, incluyendo metaanálisis, análisis filogenético e investigaciones originales, para obtener información publicada entre 2000 y 2023.
La recolección de datos se realizó en bases de datos académicas reconocidas como Google Académico, SciELO, PubMed y Web of Science, utilizando palabras clave en español e inglés, tales como “virus del papiloma humano”, “cáncer cervicouterino”, “variabilidad genética”, “VPH-16”, “VPH-18”, “E6” y “E7”. Se aplicaron criterios de inclusión y exclusión para garantizar la relevancia y calidad de la información, considerando únicamente estudios en español o inglés, publicados en revistas de acceso abierto y que abordaran directamente la relación entre la variabilidad genética del VPH y el cáncer cervical.
Se recuperaron 52 artículos, de los cuales, tras una evaluación rigurosa basada en títulos, resúmenes y criterios de selección, se analizaron en detalle 30 estudios. No fue necesario obtener aprobaciones éticas ni consentimientos informados, pero se respetaron los principios de integridad y citación adecuada de las fuentes revisadas.
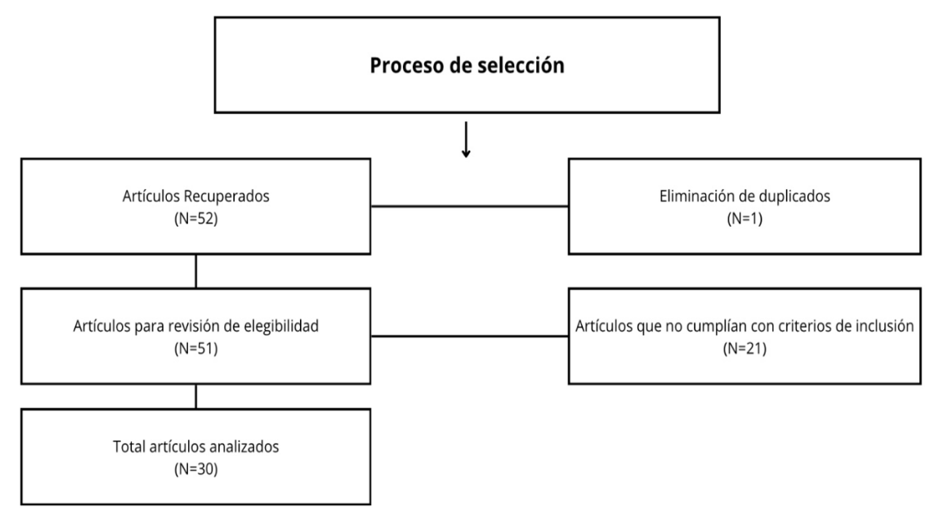
Figura 1. Proceso de selección
RESULTADOS Y DISCUSIÓN
De los 52 artículos identificados en la búsqueda inicial, se seleccionaron 30 (57.6 %) para el análisis, basándose en su relevancia para las preguntas de investigación. La selección incluyó una evaluación de calidad, validez y fiabilidad, asignándose los estudios entre los investigadores para garantizar coherencia y minimizar sesgos. Posteriormente, se realizó una revisión conjunta para validar los hallazgos y asegurar la calidad de los resultados. Estos resultados, representados en la Figura 2, muestran que, de los 52 artículos recuperados, 1 fue eliminado por ser duplicado, quedando 51. Posteriormente, 21 artículos fueron descartados por no cumplir con los criterios de inclusión, y finalmente, 30 artículos fueron seleccionados para el estudio.
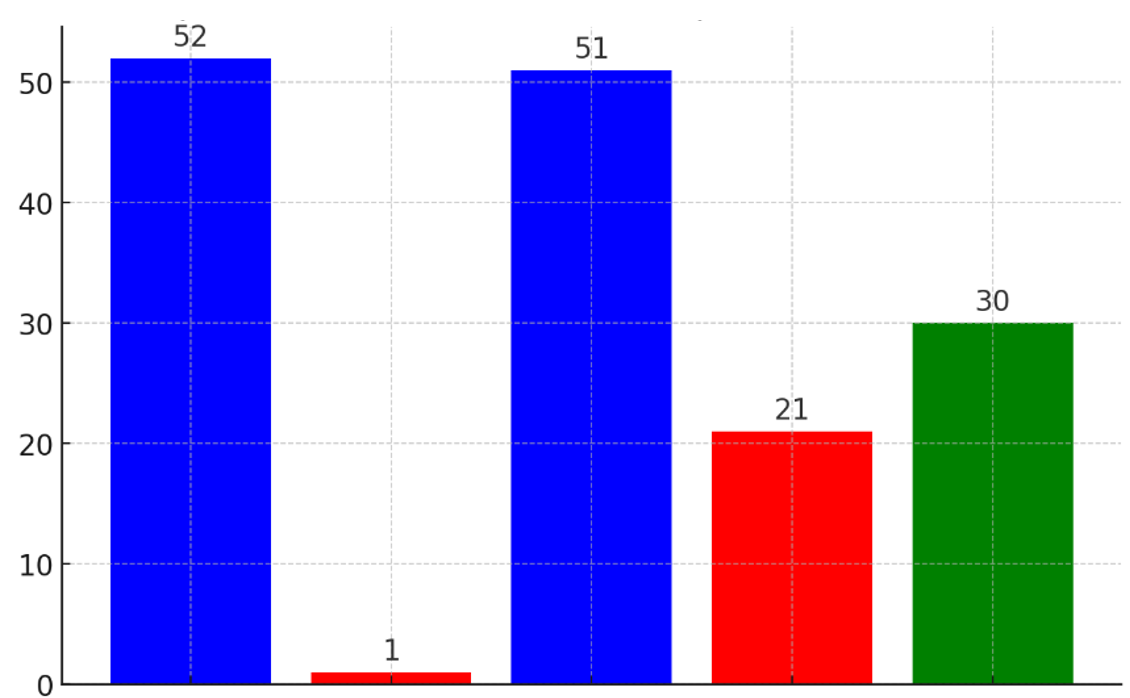
Figura 2. Comparación de artículos en el proceso de selección
Los estudios sobre la variabilidad genética del VPH tipo 16 y 18 y su relación con el cáncer cervical presentan una distribución global de publicaciones. El Reino Unido lidera con siete estudios, seguido por China con seis y Ecuador con cuatro. Otros países destacados incluyen México, Portugal y Estados Unidos, con tres publicaciones cada uno. España y Brasil cuentan con dos, mientras que Italia, Venezuela, Japón, Países Bajos, Alemania, India y Colombia presentan una publicación cada uno. En la tabla 1 se detalla la productividad por países de los artículos seleccionados.
|
Tabla 1. Productividad por países |
||
|
# |
País |
N° de las publicaciones |
|
1 |
México |
3 |
|
2 |
Ecuador |
4 |
|
3 |
España |
2 |
|
4 |
Portugal |
3 |
|
5 |
Brasil |
2 |
|
6 |
Italia |
1 |
|
7 |
Estados Unidos |
3 |
|
8 |
China |
6 |
|
9 |
Venezuela |
1 |
|
10 |
Países Bajos |
1 |
|
11 |
Japón |
1 |
|
12 |
Alemania |
1 |
|
13 |
India |
1 |
|
14 |
Colombia |
1 |
|
15 |
Reino Unido |
7 |
El análisis de los estudios seleccionados permitió identificar diferencias metodológicas en la caracterización del VPH y su relación con el cáncer cervical. Se evidenció una diversidad de modelos experimentales y enfoques analíticos, proporcionando una visión más amplia de la variabilidad genética del virus y su impacto en la progresión de la enfermedad. En la Tabla 2 se presenta la descripción de la muestra seleccionada, con información sobre los autores, año de publicación, y una síntesis de la temática abordada.
|
Tabla 2. Revisión de artículos seleccionados |
||||
|
No. |
Autor y fecha de publicación |
Revista |
Temática abordada |
País |
|
1 |
Antaño (2021) |
Universidad Autónoma de Guerrero |
Análisis estructural y funcional de las variantes génicas E7 del VPH 16 presentes en muestras cervicales de mujeres del estado de guerrero. |
México |
|
2 |
Álvarez (2017) |
Universidad de Sucre |
Carga viral de virus papiloma humano (tipo 16 y 18) en mujeres con lesión cervical del departamento de sucre |
Ecuador |
|
3 |
Carrero (2019) |
Universidad Técnica de Ambato |
Situación actual del virus del papiloma humano de alto y bajo riesgo asociado a lesiones cervicales en mujeres del ecuador. |
Ecuador |
|
4 |
Arroyo et al. (2015) |
Universidad Autónoma de Barcelona |
Detección e identificación de los virus del papiloma humano. Caracterización de dos nuevas variantes |
España |
|
5 |
Osorio (2018) |
Centro de investigación científica y de educación superior de ensenada, Baja California |
Determinación del potencial oncogénico de algunas especies de VPH mediante el análisis in silico de la interacción entre las proteínas E6 y E6AP |
México |
|
6 |
Estêvão et al. (2019) |
Gene regulatory mechanisms |
Hallmarks of HPV carcinogenesis: the role of E6, E7 and E5 oncoproteins in cellular malignancy |
Portugal |
|
7 |
Ma, yanyun (2022) |
Molecular and Clinical Oncology |
Searching for the methylation sites involved in human papillomavirus type 16 and 18-positive women with cervical cancer |
China |
|
8 |
Santos (2023) |
The Brazilian Journal of Infectious Diseases |
HPV 18 variants in women with cervical cancer in Northeast Brazil |
Brazil |
|
9 |
Frati (2011) |
Infection, genetics and Evolution |
Genetic variability in the major capsid L1 protein of human papillomavirus type 16 (HPV-16) and 18 (HPV-18) |
Italia |
|
10 |
Núñez-Troconis (2023) |
Investigación Clínica |
Papel del virus del papiloma humano en el desarrollo del cáncer del cuello uterino. |
Venezuela |
|
11 |
Sun (2013) |
BMC Cancer |
Genetic variations of E6 and long control region of human papillomavirus type 16 from patients with cervical lesion in liaoning, china |
China |
|
12 |
Villa et al. (2000) |
Journal of General Virology |
Molecular variants of human papillomavirus types 16 and 18 preferentially associated with cervical neoplasia |
Brazil |
|
13 |
Yue et al. (2013) |
Plos One |
Genetic variability in L1 and L2 genes of HPV-16 and HPV-58 in southwest china |
Portugal |
|
14 |
King et al. (2016) |
Plos one |
Genetic diversity in the major capsid L1 protein of HPV-16 and HPV-18 in the netherlands |
Paises Bajos |
|
15 |
Evans (2001) |
J immunol |
Antigen processing defects in cervical carcinomas limit the presentation of a CTL epitope from human papillomavirus 16 E6. |
Reino Unido |
|
16 |
Sitas (2007) |
Infect Agent Cancer |
The relationship between anti-HPV-16 igg seropositivity and cancer of the cervix, anogenital organs, oral cavity and pharynx, esophagus, and prostate in a black South African population. |
Reino Unido |
|
17 |
Zhang et al. (2021) |
Front Immunology |
HPV-16 e7-specific cellular immune response in women with cervical intraepithelial lesion contributes to viral clearance: A cross-sectional and longitudinal clinical study. |
Reino Unido |
|
18 |
Collazo (2019) |
Revista Estudiantil Ceus |
Virus de papiloma humano, cáncer cérvico uterino y modificaciones epigenéticas |
Ecuador |
|
19 |
Mazarico et al. (2012) |
Universidad de Barcelona |
Relación existente entre la infección por los diferentes genotipos del virus del papiloma humano y la presencia de patología premaligna y maligna del cuello uterino |
España |
|
20 |
Fern (2021) |
Plos One |
HPV16 E1 dysregulated cellular genes involved in cell proliferation and host |
Reino Unido |
Preguntas de investigación
¿Cuál es la variabilidad genética presente en el VPH y cómo influye en el riesgo del cáncer cervical en mujeres?
Los genes del VPH responsables de la variabilidad genética se dividen en dos grupos: genes tempranos (E1-E7) y genes tardíos (L1 y L2). Los primeros son clave en la replicación viral y la evasión de la respuesta inmune, mientras que los tardíos participan en la formación de la cápside viral y la respuesta inmune (Núñez, 2023; Álvarez, 2017). La variabilidad genética del VPH influye en la transcripción viral, la persistencia de la infección y la integración del virus en el genoma del huésped, contribuyendo a la oncogénesis (Stanley, 2006; Michels et al., 2009; Yuan et al., 2013).
Las proteínas L1 y L2 son esenciales para el ciclo viral y la respuesta inmune, y sus alteraciones pueden facilitar la evasión del sistema inmunológico, aumentando el riesgo de cáncer (Álvarez, 2017). La proteína E1 está asociada con la replicación viral y puede inducir la muerte celular (Chaiwongkot et al., 2021), mientras que E2 regula la transcripción y replicación del virus, interactuando con proteínas celulares como p53, siendo clave en la actividad de los oncogenes E6 y E7 (Ramírez, 2020).
La proteína E4 se considera un biomarcador viral útil en la detección del VPH, especialmente cuando se combina con otros marcadores como p16 (Griffin et al., 2012). E5 afecta la señalización celular y la evasión inmune (Báez, 2019). Por otro lado, E6 y E7 desempeñan un papel central en la progresión del cáncer cervical, ya que interfieren con proteínas supresoras de tumores como p53 y pRb, promoviendo la proliferación celular incontrolada (Evans et al., 2001; Zhang et al., 2021; Pande et al., 2008).
Las variaciones en E6 y E7 pueden usarse como biomarcadores para predecir el riesgo de cáncer cervical y desarrollar estrategias personalizadas de prevención y tratamiento (Liu et al., 2018; Chen et al., 2010).
¿Qué papel juegan las variantes en los genes E6 y E7 del VPH-16 y VPH-18 en la progresión del cáncer cervical?
Las oncoproteínas E6 y E7 regulan procesos clave como el control del ciclo celular, la apoptosis y la evasión del sistema inmune, afectando múltiples vías metabólicas y de señalización (Bizuela, 2018). La pérdida de E2 provoca un aumento en los niveles de E6 y E7, lo que genera inestabilidad genómica y anomalías cromosómicas. Se ha observado que la expresión de E6 y E7 aumenta progresivamente desde lesiones CIN1 hasta CIN3, convirtiéndolas en objetivos para la inmunoterapia basada en CTL (Báez, 2019; Evans, 2001).
La región de control largo (LCR) del VPH-16 y VPH-18 es la parte más variable del genoma, desempeñando un papel crucial en la persistencia del virus y el desarrollo del cáncer cervical (Xi, 2017). Estudios indican que polimorfismos en E6 o en LCR pueden modificar el potencial oncogénico del virus (Sun, 2013).
La proteína E6 interactúa con E6AP, facilitando la degradación de p53 mediante la ubiquitina ligasa E3, lo que impide la apoptosis celular (Osorio, 2018). Además, E6 regula positivamente la actividad de la telomerasa, permitiendo la estabilidad de los telómeros y favoreciendo la proliferación celular (Báez, 2019; Lechner, 1992).
El ARNm de E7 se asocia con la progresión del cáncer cervical y su detección es más efectiva que la del ADN del VPH para identificar lesiones precancerosas (Liu et al., 2018). La expresión del gen E7 en lesiones cervicales precancerosas sugiere una progresión temprana hacia el cáncer cervical, lo que destaca su importancia como biomarcador (Pande et al., 2008).
La variante del gen E7 del VPH-16 y VPH-18 contribuye a la progresión del cáncer cervical al inactivar proteínas supresoras de tumores como p53 y Rb1, promoviendo la proliferación celular descontrolada y la expresión de la telomerasa (Álvarez, 2017).
Limitaciones del estudio
La principal limitación del estudio fue la falta de información actualizada sobre la variabilidad genética del VPH-16 y VPH-18 en relación con el cáncer cervical. Aunque se amplió el rango temporal de búsqueda a los últimos 23 años, esto destacó la necesidad de investigaciones más recientes. Además, se excluyeron artículos de revistas de acceso restringido debido a su limitada disponibilidad.
Implicaciones y futuras investigaciones
Los estudios prospectivos pueden proporcionar información clave sobre la progresión del cáncer cervical en mujeres infectadas con variantes específicas del VPH. Investigaciones experimentales analizarían cómo las mutaciones afectan la oncogénesis y la respuesta a vacunas y tratamientos. Estudios de casos y controles evaluarían la influencia de la variabilidad genética en la eficacia de las terapias, mientras que metaanálisis sintetizarían resultados previos sobre el riesgo de cáncer cervical.
Aplicaciones en la práctica médica
Se destaca la necesidad de integrar un enfoque personalizado en la detección y prevención del cáncer cervical. Esto incluye estrategias como la educación en salud, la detección temprana del VPH, la vacunación contra los tipos 16 y 18, y el uso de pruebas para identificar lesiones precancerosas. Además, se enfatiza la importancia de comprender la variabilidad genética del VPH para desarrollar tratamientos más efectivos y personalizados.
CONCLUSIONES
A pesar de los avances médicos, el cáncer cervical sigue siendo una de las principales causas de muerte en mujeres a nivel mundial. El Virus del Papiloma Humano (VPH), especialmente los tipos 16 y 18, es el principal responsable de esta enfermedad. La integración del VPH en las células huésped desencadena eventos que conducen a la formación de células malignas. Las proteínas E6 y E7, codificadas por el VPH, interfieren con las proteínas supresoras de tumores, promoviendo la proliferación celular descontrolada y evitando la apoptosis. La variabilidad genética del VPH, particularmente en las regiones E6, E7 y LCR, es clave en la progresión del cáncer cervical, ya que influye en la respuesta inmunitaria y puede afectar la eficacia de vacunas y terapias. La sobreexpresión de E6 y E7 es crucial en la transformación maligna de las células cervicales. Identificar variantes como biomarcadores permite predecir el riesgo y personalizar estrategias de prevención y tratamiento.
AGRADECIMIENTOS
Agradecemos a la Dra. Fernanda Gómez García M. Gs. por su valiosa orientación y asesoría en el desarrollo del tema, cuya experiencia fue fundamental para la elaboración de este artículo. Asimismo, expresamos nuestro reconocimiento al Dr. Eugenio Radamés Borroto Cruz por su guía, orientación y contribuciones durante el desarrollo del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Antaño Arias R. Análisis estructural y funcional de las variantes génicas E7 del VPH 16 presentes en muestras cervicales de mujeres del estado de Guerrero. 2021.
2. Álvarez García LM. Carga viral de virus papiloma humano (tipo 16 y 18) en mujeres con lesión cervical del departamento de Sucre [Tesis de Maestría]. Maestría en Biología; 2017.
3. Arroyo Andújar JD. Detección e identificación de los virus del papiloma humano. Caracterización de dos nuevas variantes. Universitat Autònoma de Barcelona; 2015.
4. Baez Murcia IM. Dinámica de la carga viral de seis tipos de VPH de alto riesgo en presencia de infecciones por Chlamydia trachomatis. 2019.
5. Baedyananda F, Chaiwongkot A, Varadarajan S, Bhattarakosol P. HPV16 E1 dysregulated cellular genes involved in cell proliferation and host DNA damage: A possible role in cervical carcinogenesis. Plos One. 2021;16(12):e0260841.
6. Cai HB, Chen CC, Ding XH. Human papillomavirus type 16 E6 gene variations in Chinese population. European Journal of Surgical Oncology. 2010;36(2):160-163.
7. Evans M, Borysiewicz LK, Evans AS, Rowe M, Jones M, Gileadi U, et al. Antigen processing defects in cervical carcinomas limit the presentation of a CTL epitope from human papillomavirus 16 E6. The Journal of Immunology. 2001;167(9):5420-5428.
8. Estêvão D, Costa NR, da Costa RMG, Medeiros R. Hallmarks of HPV carcinogenesis: The role of E6, E7 and E5 oncoproteins in cellular malignancy. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms. 2019;1862(2):153-162.
9. Falcón Córdova DC. Situación actual del virus del papiloma humano (VPH) de alto y bajo riesgo asociado a lesiones cervicales en mujeres del Ecuador [Tesis de Licenciatura]. Universidad Técnica de Ambato; 2019.
10. Frati E, Bianchi S, Colzani D, Zappa A, Orlando G, Tanzi E. Genetic variability in the major capsid L1 protein of human papillomavirus type 16 (HPV-16) and 18 (HPV-18). Infection, Genetics and Evolution. 2011;11(8):2119-2124.
11. Griffin H, Wu Z, Marnane R, Dewar V, Molijn A, Quint W, et al. E4 antibodies facilitate detection and type-assignment of active HPV infection in cervical disease. Plos One. 2012;7(12):e49974.
12. King AJ, Sonsma JA, Vriend HJ, Van Der Sande MA, Feltkamp MC, Boot HJ, et al. Genetic diversity in the major capsid L1 protein of HPV-16 and HPV-18 in the Netherlands. Plos One. 2016;11(4):e0152782.
13. Kines RC, Thompson CD, Lowy DR, Schiller JT, Day PM. The initial steps leading to papillomavirus infection occur on the basement membrane prior to cell surface binding. Proceedings of the National Academy of Sciences. 2009;106(48):20458-20463.
14. Liu S, Minaguchi T, Lachkar B, Zhang S, Xu C, Tenjimbayashi Y, et al. Separate analysis of human papillomavirus E6 and E7 messenger RNAs to predict cervical neoplasia progression. Plos One. 2018;13(2):e0193061.
15. Ma Y, Wang C, Shi M, Li M, Li L, Che T, Qu J. Searching for the methylation sites involved in human papillomavirus type 16 and 18‑positive women with cervical cancer. Molecular and Clinical Oncology. 2022;17(4):1-12.
16. Mazarico Gallego E. Relación existente entre la infección por los diferentes genotipos del Virus del Papiloma Humano y la presencia de patología premaligna y maligna del cuello uterino. 2012.
17. Mandal P, Bhattacharjee B, Das Ghosh D, Mondal NR, Roy Chowdhury R, Roy S, Sengupta S. Differential expression of HPV16 L2 gene in cervical cancers harboring episomal HPV16 genomes: influence of synonymous and non-coding region variations. Plos One. 2013;8(6):e65647.
18. Núñez-Troconis J. Papel del virus del papiloma humano en el desarrollo del cáncer del cuello uterino. Investigación Clínica. 2023;64(2):233-254. https://doi.org/10.54817/ic.v64n2a09.
19. Pando LSSO. Determinación del potencial oncogénico de algunas especies de VPH mediante el análisis in silico de la interacción entre las proteínas E6 y E6AP. 2018.
20. Pande S, Jain N, Prusty BK, Bhambhani S, Gupta S, Sharma R, et al. Human papillomavirus type 16 variant analysis of E6, E7, and L1 genes and long control region in biopsy samples from cervical cancer patients in north India. Journal of Clinical Microbiology. 2008;46(3):1060-1066.
21. Román-Collazo C, Merchán-Jara MJ, Andrade-Campoverde D, Campoverde-Valverde E, Guaillazaca-Matute L. Virus de Papiloma Humano, cáncer cérvico uterino y modificaciones epigenéticas. Revista Estudiantil CEUS (Ciencia Estudiantil Unidad de Salud). 2019;1(2):11-18.
22. Santos GRBD, Cunha APA, Batista ZDS, Silva MACND, Figueiredo FVD, Santos FRBD, et al. HPV 18 variants in women with cervical cancer in Northeast Brazil. Brazilian Journal of Infectious Diseases. 2023;27(01):102734.
23. Shen M, Ding X, Li T, Chen G, Zhou X. Sequence variation analysis of HPV-18 isolates in southwest China. Plos One. 2013;8(2):e56614.
24. Sun Z, Lu Z, Liu J, Wang G, Zhou W, Yang L, et al. Genetic variations of E6 and long control region of human papillomavirus type 16 from patients with cervical lesion in Liaoning, China. BMC Cancer. 2013;13:1-8.
25. Sitas F, Urban M, Stein L, Beral V, Ruff P, Hale M, et al. The relationship between anti-HPV-16 IgG seropositivity and cancer of the cervix, anogenital organs, oral cavity and pharynx, oesophagus and prostate in a black South African population. Infectious Agents and Cancer. 2007;2:1-9.
26. Venegas R, de los Ángeles M. Análisis del efecto de E2 del VPH16 sobre la vía de p53 en respuesta a daño inducido por doxorrubicina [Tesis de Maestría]. Centro de Investigación y de Estudios Avanzados del IPN; 2020.
27. Villa LL, Sichero L, Rahal P, Caballero O, Ferenczy A, Rohan T, Franco EL. Molecular variants of human papillomavirus types 16 and 18 preferentially associated with cervical neoplasia. Journal of General Virology. 2000;81(12):2959-2968.
28. Xi J, Chen J, Xu M, Yang H, Luo J, Pan Y, et al. Genetic variability and functional implication of the long control region in HPV-16 variants in Southwest China. Plos One. 2017;12(8):e0182388.
29. Yue Y, Yang H, Wu K, Yang L, Chen J, Huang X, et al. Genetic variability in L1 and L2 genes of HPV-16 and HPV-58 in Southwest China. Plos One. 2013;8(1):e55204.
30. Zhang L, Shi X, Zhang Q, Mao Z, Shi X, Zhou J, et al. HPV-16 E7-specific cellular immune response in women with cervical intraepithelial lesion contributes to viral clearance: A cross-sectional and longitudinal clinical study. Frontiers in Immunology. 2022;12:768144.
FINANCIACIÓN
Ninguna.
CONFLICTOS DE INTERÉS
Los autores declaran no tener conflicto de interés.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Rosa M. Macías, Nayeli Y. Tejena, Eugenio R. Borroto.
Investigación: Rosa M. Macías, Nayeli Y. Tejena, Eugenio R. Borroto.
Redacción – borrador inicial: Rosa M. Macías, Nayeli Y. Tejena, Eugenio R. Borroto.
Redacción – revisión y edición: Rosa M. Macías, Nayeli Y. Tejena, Eugenio R. Borroto.